合作客戶/
拜耳公司 |
同濟大學 |
聯合大學 |
美國保潔 |
美國強生 |
瑞士羅氏 |
相關新聞Info
-
> 噴霧液滴的形成原理與配方設計:動態表面張力與粒徑的關系
> Delta-8食用餐食后人體內十二指腸液的組成及性質——結果和討論、結論、致謝!
> uv油墨消泡劑還你一個多彩的世界!
> 產低溫β-甘露聚糖酶的菌株O5提升低溫油藏壓裂液的破膠性能——實驗部分
> 軸對稱懸滴法表面張力實驗系統研制及二甲基亞砜/甲醇混合物表面張力實驗研究
> 表面張力儀測試添加消泡劑后起泡液、水性丙烯酸膠黏劑的變化(一)
> 可視化實驗方法研究電場作用下液滴撞擊表面的動態行為(四)
> 蒙藥滴丸劑制備與表面張力有何關系?
> 采用殼聚糖-三聚磷酸酯-百里香納米顆粒經熱噴墨打印而成的新型活性包裝材料——材料和方法
> 超微量天平應用于高阻燃輻照交聯低煙無鹵聚烯烴制備
推薦新聞Info
-
> Wilhelmy吊板法測試溫度、鋁元素和稀土元素對鋅浴表面張力的影響
> 基于表面張力系數等模擬液滴撞擊熱壁面的動力學行為(二)
> 基于表面張力系數等模擬液滴撞擊熱壁面的動力學行為(一)
> 10種常用表面活性劑水溶液的表面張力測定、泡沫的產生和測試(三)
> 10種常用表面活性劑水溶液的表面張力測定、泡沫的產生和測試(二)
> 10種常用表面活性劑水溶液的表面張力測定、泡沫的產生和測試(一)
> 雙鏈乳糖酰胺季銨鹽表面活性劑物化性能、應用性能及復配性能研究
> ABA型聚醚改性有機硅表面活性劑在不同溶劑中的泡沫性能的相關性
> 什么是超微量天平?超微量天平用在什么地方
> 表面能和表面張力關系,如何降低表面張力
誘導期測定法研究NaCl的添加對碳酸鋰固-液界面張力等成核動力學參數影響——結果與討論
來源:高等學校化學學報 瀏覽 96 次 發布時間:2025-02-14
3結果與討論
3.1溫度和過飽和度對Li2CO3成核誘導期的影響
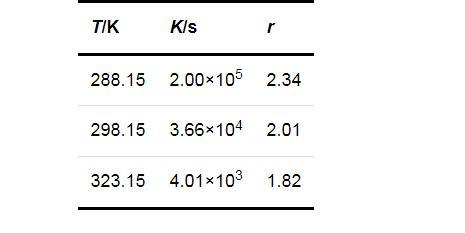
溫度和過飽和度是影響晶體成核誘導期的兩個重要因素,分別在288.15,298.15和323.15 K時測定了不同過飽和度下Li2CO3的成核誘導期,結果如圖1所示.可知,在同一過飽和度下,Li2CO3的成核誘導期隨溫度的升高而縮短;在同一溫度下,Li2CO3的成核誘導期隨過飽和度的增大而縮短,并且這種趨勢在低溫(288.15 K)下更為明顯.
Liu和Nancollas[32]提出了一個反映成核誘導期(tind)與溫度關系的經驗方程式:
tind=τexp(Eact/RT)(7)
式中:Eact(J/mol)為成核反應的活化能,表示從反應物到生成物需要克服的能壘高度;τ為常數.
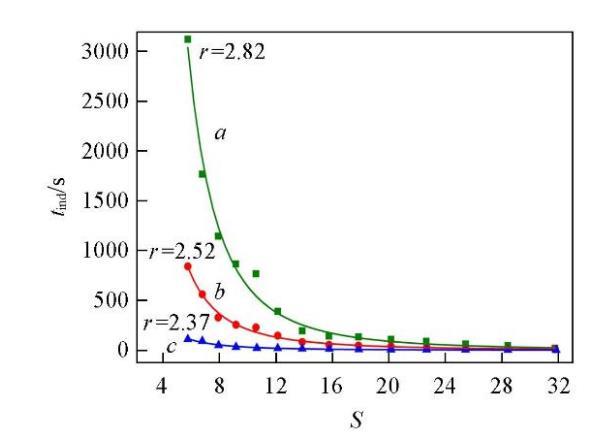
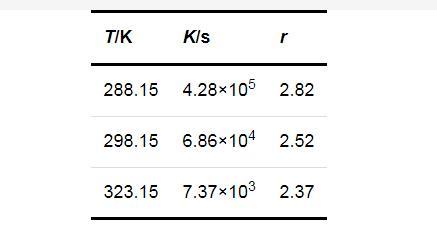
圖2顯示了3個不同的過飽和度下lntind與1/T的關系.可見,lntind與1/T之間呈線性關系,由直線的斜率可以計算得到Li2CO3的成核活化能Eact為63.69 kJ/mol.
成核誘導期與過飽和度的半經驗關系式[33]如下:

tind=K/Sr(8)
式中:K和r均為方程參數,可由實驗數據回歸得出.將圖1的數據回歸結果列于表1.進一步說明了過飽和度對成核誘導期的影響在較低的溫度下更為顯著.
3.2固-液界面張力的計算
為了更深入地研究Li2CO3的成核過程,將以Li2CO3晶核與周圍溶液間的固-液界面張力為切入點來探討其成核機制.
晶核與周圍溶液間的固-液界面張力γS(J/m2)是計算和模擬晶體成核以及晶體生長速率的基本參數[34].根據經典初級成核理論[16],成核速率J[個/(cm3·s)]可表示為
J=Aexp[?βγ3SV2mNAf(θ)(RT)3(ln S)2](9)
式中:A為頻率常數,代表單位時間內粒子碰撞晶體表面的次數;β為晶體的形狀因子(對于球形顆粒,其數值為16π/3);Vm為晶體的摩爾體積(對于Li2CO3晶體,其值為35.01 cm3/mol[35]);NA為阿伏伽德羅常數;f(θ)為修正因子[36],晶體的成核過程為均相成核時f(θ)=1,晶體的成核過程為非均相成核時f(θ)<1.
對于初級均相成核,成核速率與誘導期tind成反比,因此,式(9)可改為如下形式:
lgtind=B(lgS)2+C(10)
式中:C為方程常數;B=βγ3SV2mNAf(θ)/(2.3RT)3
.所以,固-液界面張力γS可由下式計算:
γS=2.3RT(BβV2mNAf(θ))1/3(11)
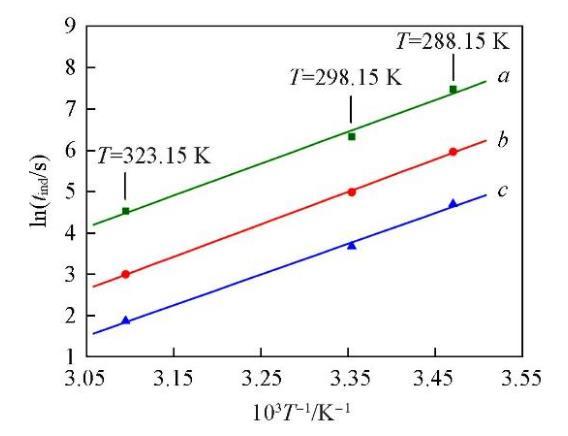
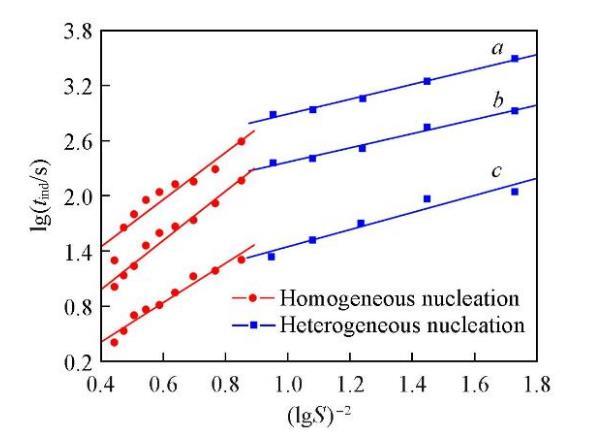
誘導期與初始過飽和度之間存在著很強的依賴關系.當初始過飽和度足夠高時,成核可認為是均相的;當初始過飽和度足夠低時,成核則以非均相為主[37].在恒定溫度下,由晶體成核過程中的lgtind對(lgS)?2作圖可得兩條斜率不同的直線,分別對應著兩種不同的成核機制,即初級均相成核和初級非均相成核[37].由不同溫度時Li2CO3的lgtind對(lgS)?2作圖,結果如圖3所示.可知,成核機制的變化引起了直線斜率的改變,均相成核對應的直線斜率明顯大于非均相成核時的直線斜率(Bhom>Bhet).在較低的過飽和度時,成核以非均相成核為主;而過飽和度增大到12.13以后,成核則以均相成核為主.
根據均相成核和非均相成核理論,在非均相成核條件下形成臨界晶核所需自由能的變化(ΔGhet)與均相成核條件下形成臨界晶核所需自由能的變化(ΔGhom)間的關系為

ΔGhet=φΔGhom(12)
式中:φ為形狀因子(0<φ<1),表示溶液體系中外來微粒的表面分子對溶質分子有序化的影響,計算如下:
φ=BhetBhom(13)
假設晶核形狀為球形,則
φ=2?3cosθ+(cosθ)34(14)
式中:θ為晶核與外來固態雜質之間的接觸角(0°≤θ≤180°),反映晶核與外來雜質之間的親和程度,從而決定外來雜質對初級成核的影響.
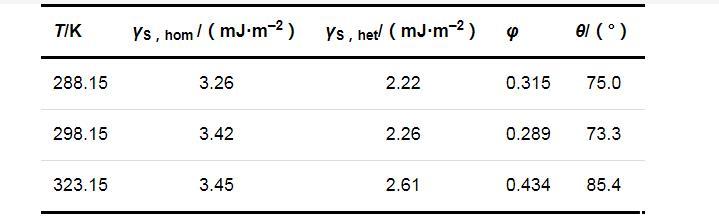
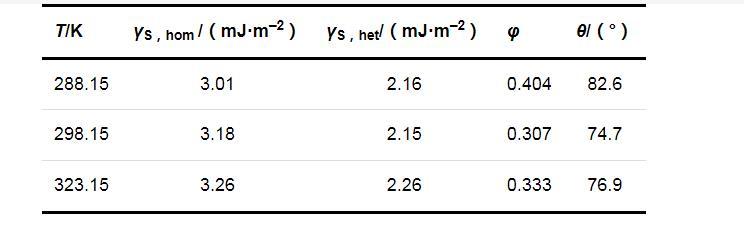
兩種成核機制時的固-液界面張力(γS,hom和γS,het)、形狀因子(φ)和接觸角(θ)的計算結果列于表2.可以看出,在同一溫度下,均相成核時的固-液界面張力大于非均相成核時的固-液界面張力;溫度對固-液界面張力的影響并不明顯,固-液界面張力只隨溫度的升高略有增加.
3.3 NaCl的添加對Li2CO3成核的影響
分別在288.15,298.15和323.15 K時研究了NaCl的添加對Li2CO3成核誘導期的影響,每組實驗均在Cl?的超額含量(Y=0.5)的條件下進行,結果見圖4.可知,在同一溫度下,Li2CO3的成核誘導期仍然隨過飽和度的增大而縮短;在同一過飽和度下,Li2CO3的成核誘導期隨溫度的升高而縮短,而且在添加NaCl(Y=0.5)后,溫度對Li2CO3成核誘導期的影響比未添加(Y=0)時更為顯著.如,在過飽和度S=5.76,溫度從288.15 K升高到323.15 K時,添加NaCl后Li2CO3的成核誘導期縮短了73.01%,而未添加NaCl時Li2CO3的成核誘導期縮短了67.89%.
將圖1與圖4對比可知,添加NaCl后Li2CO3的成核誘導期明顯增長,說明體系中過量Cl?的存在抑制了Li2CO3的成核.用圖4中的實驗數據回歸了式(8)中的參數數值,結果列于表3.由回歸的參數數值可知,過飽和度對誘導期的影響仍然是在較低的溫度下更為顯著.
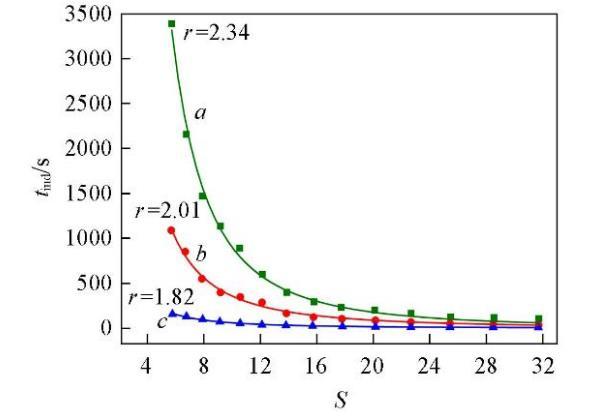
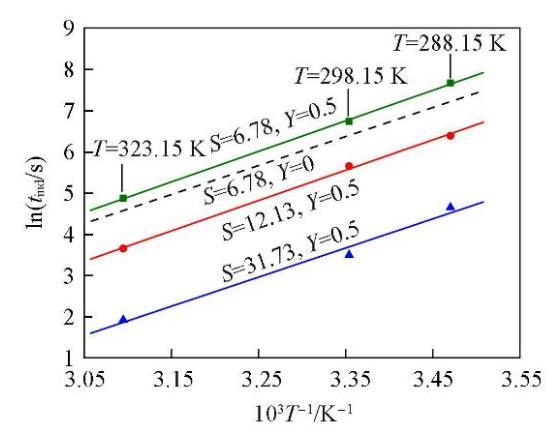
圖5為添加NaCl后,在3個不同的過飽和度(Y=0.5;S=6.78,12.13,31.73)下lntind與1/T的關系圖.并將未添加NaCl,過飽和度S=6.78時lntind與1/T的關系曲線作為對比,以虛線表示.可以看出,這條虛線的斜率比圖中3條平行直線的斜率小,表明添加NaCl后,溫度對Li2CO3成核誘導期的影響更為顯著.由圖5中3條平行直線的斜率計算可得,添加NaCl后(Y=0.5)Li2CO3成核反應的活化能為72.85 kJ/mol,明顯高于未添加NaCl時(Y=0)的活化能63.69 kJ/mol.進一步說明添加NaCl后,體系中過量Cl?的存在對Li2CO3的成核過程產生了抑制作用.
由圖6可以看出,兩種成核機制的分界點大約在S=12.13處,過飽和度小于此數值時成核以非均相成核為主,大于此數值后成核以均相成核為主.添加NaCl后,兩種成核機制的固-液界面張力(γS,hom和γS,het)、形狀因子(φ)和接觸角(θ)的計算結果列于表4.可以看出,在同一溫度下,均相成核時的固-液界面張力大于非均相成核時的固-液界面張力;溫度的改變對固-液界面張力的影響仍不明顯.通過對比表2與表4的數據可知,添加NaCl后Li2CO3晶核與周圍溶液的固-液界面張力與未添加NaCl時的數值相比略有減小,所以在Li2CO3成核過程中,NaCl的添加對晶核與周圍溶液的固-液界面張力的影響可以忽略.
4結論
在288.15~323.15 K的溫度范圍內,使用激光在線裝置測量了Li2CO3在過飽和度(S)為5.76~31.73范圍內的成核誘導期.其中,Li2CO3在溶液中的過飽和度采用OLI電解質與水化學物性分析軟件內嵌的全組分模型嚴格計算.通過研究溫度、過飽和度以及NaCl的添加(Y=0.5)對Li2CO3在LiCl-Na2CO3溶液體系中成核誘導期的影響,發現在同一過飽和度下,Li2CO3的成核誘導期隨溫度的升高而縮短;在同一溫度下,過飽和度的增大加快了Li2CO3的成核.添加NaCl后Li2CO3的成核誘導期明顯增長,說明體系中過量Cl?的存在抑制了Li2CO3的成核,并且這種抑制現象在較低的溫度下更為顯著.通過計算可知,添加NaCl后Li2CO3成核反應的活化能(Y=0.5,72.85 kJ/mol)明顯高于未添加NaCl時的活化能(Y=0,63.69 kJ/mol),進一步說明了NaCl對Li2CO3成核產生了抑制作用.最后通過所測得Li2CO3的成核誘導期和過飽和度的關系式計算了晶核和周圍溶液間的固-液界面張力.結果表明,在同一溫度下,均相成核時的固-液界面張力始終大于非均相成核時的固-液界面張力,溫度的改變以及NaCl的添加對它們的影響均可忽略.研究結果為研究Li2CO3的結晶過程提供了重要的理論指導和數據支撐,也為鹽湖提鋰工藝的優化提供了借鑒.










